Glucolisis y fermentación
Tomado de: http://b-log-ia20.blogspot.mx/2010/02/glucolisis-y-fermentacion.html
El ambiente en el que evolucionaron
los seres vivos primitivos carecía de oxígeno. La aparición de este
compuesto, ocurrida hace unos 3.000 millones de años como consecuencia
de la evolución de la fotosíntesis oxigénica, supuso una verdadera
catástrofe para los organismos que existían en aquella época, porque el
oxígeno resultaba tremendamente tóxico para ellos. Algunos consiguieron
adaptarse a las nuevas condiciones, incluso utilizando el nuevo
compuesto como un elemento básico de su metabolismo, y de ellos proceden
todos los organismos aerobios actuales. Sin embargo, todos los seres
vivos actuales conservamos, como un resto evolutivo, algunas rutas
metabólicas que ya existían antes de la evolución del oxígeno y que han
permanecido como elementos centrales de nuestro funcionamiento: la
glucolisis y las fermentaciones.
Glucolisis
La glucolisis es, seguramente,
la ruta metabólica más antigua que se conserva, como lo prueba su
presencia en todos los seres vivos y la naturaleza química de las
reacciones que tienen lugar en ella. Se trata de un conjunto de procesos
que hacen posible la degradación oxidativa de la glucosa (y de otros
monosacáridos que pueden transformarse en ella) en ausencia de oxígeno.
Sin embargo, en estas condiciones la oxidación de los monosacáridos es
solo parcial, dando lugar a compuestos orgánicos que no están totalmente
oxidados.
La producción de energía en
la fosforilación ocurre exclusivamente mediante fosforilación a nivel de
sustrato, mientras que los electrones y los protones que se arrancan de
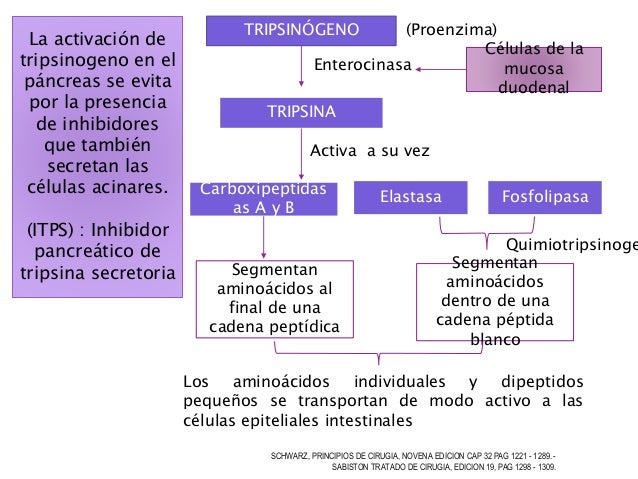
la glucosa a lo largo del proceso acaban siendo transferidos al NAD+ para dar lugar a NADH+H+. El compuesto final que se obtiene como resultado de la degradación es el piruvato:La glucolisis tiene lugar en el citoplasma de las células eucariotas, circunstancia que tiene su interés, porque apoya la teoría de que los eucariotas evolucionaron a partir de procariotas anaerobios; de hecho, el oxígeno resulta tóxico en el citoplasma, y la célula lo envía rápidamente hacia la mitocondria, donde puede aprovecharse.
Descripción del proceso
Desde el punto de vista químico pueden distinguirse varias etapas distintas en la glucolisis, mediante las cuales se van "preparando" paulatinamente los diferentes compuestos para facilitar la reacción global:
- Fase de activación: requiere el aporte de energía en forma de ATP, que se recuperará en reacciones posteriores. La activación permite que los compuestos activados reaccionen con mayor facilidad. Esta "inversión energética" recuperable se da en muchos procesos metabólicos.
- Transformación de la glucosa en glucosa 6-fosfato: La glucosa reacciona con una molécula de ATP, fosforilándose y liberando ADP. En realidad no se trata de un proceso de activación energética (aunque también sea necesario para eso), sino que tiene un motivo diferente desde el punto de vista de la lógica celular. La membrana plasmática permite el paso de loa glucosa mediante difusión facilitada a través de transportadores específicos. Esto haría imposible la acumulación de glucosa dentro de la célula, ya que ese transporte es bidireccional y a favor de gradiente. La modificación química de la glucosa, concretamente la fosforilación, impide que la glucosa 6-fosfato salga de la célula (porque no existe transportador para ella). Toda la glucosa intracelular está fosforilada.
- Transformación de la glucosa 6-fosfato en fructosa 6-fosfato: Es una reacción de isomerización espontánea y reversible, que transforma la forma aldosa en la cetosa. La glucosa 6-fosfato es una sustancia que puede participar en varias rutas metabólicas, mientras que la fructosa 6-fosfato solo interviene en la glucolisis. La formación de este compuesto permite, por lo tanto, regular la cantidad de glucosa que se metaboliza y, en consecuencia, la cantidad de energía que se va a producir mediante esta ruta.
- Transformación de la fructosa-6-fosfato en fructosa 1,6-difosfato: Con esta nueva fosforilación se consigue que el compuesto alcance la energía interna suficiente para sufrir la siguiente reacción.
- Rotura de la fructosa 1,6-difosfato: La molécula se rompe en dos mitades del mismo tamaño, gliceraldehído 3-fosfato y dihidoxiacetona fosfato. Ambos compuestos son isómeros entre sí (son las formas fosforiladas de las dos triosas que existen), y de hecho se transforman la una en la otra en una reacción espontánea y reversible. Este equilibrio es fundamental en la continuación de la ruta, ya que solo el gliceraldehído 3-fosfato es metabolizado. Sin embargo, a medida que dicha sustancia se va consumiendo, la dihidroxiacetona fosfato se transforma en gliceraldehído, de acuerdo con el principio de equilibrio químico.
- Oxidación y fosforilación a nivel de sustrato: La última fase de la glucolisis consiste en una srie de reacciones que, conjuntamente, suponen su oxidación parcial acoplada a la fosforilación a nivel de sustrato que sintetiza más ATP del que se había consumido durante la activación. Los electrones y protones separados en el proceso se ceden a una coenzima de oxidación-reducción.
- Transformación del gliceraldehído 3-fosfato en 1,3-difosfoglicerato: se trata de una oxidación tan exotérmica que basta para unir un grupo de fosfato inorgánico al grupo ácido recién formado. Los electrones y los protones separados de la molécula de gliceraldehído 3-fosfato son cedidos al NAD+ para formar una molécula de NADH+H+ (dos por cada molécula de glucosa).
- Fosforilación de ADP y formación de 3-fosfoglicerato: El 1,3-difosfoglicerato reacciona con el ADP dando lugar a las primeras moléculas de ATP que se producen en la ruta metabólica. Como cada molécula de glucosa ha permitido la formación de dos moléculas de 1,3-difosfoglicerato en esta reacción se recupera la energía invertida en la activación del monosacárido.
- Recuperación de la energía proporcionada para la activación: El 3-fosfoglicerato conserva aún el grupo fosfato que se había unido durante la fase de activación. El final de la glucolisis permite la recuperación de este ATP, proporcionando por tanto un balance energético positivo. Para que esta reacción sea posible, es necesario que antes el 3-fosfoglicerato sufra ciertas modificaciones quimicas.
- Transformación del 3-fosfoglicerato en 2-fosfoglicerato: El grupo fosfato cambia de posición dentro de la molécula, lo que facilita las reacciones posteriores.
- Deshidratación del 2-fosfoglicerato: Da lugar a un compuesto llamado fosfoenolpiruvato.
- Formación de piruvato y ATP: El fosfoenolpiruvato reacciona con el ADP transfiriéndole el grupo fosfato. El producto final de la glucolisis es el piruvato.
El compuesto final de la degradación de la glucosa mediante esta vía es el piruvato, una molécula de tres átomos de carbono que aún está parcialmente reducida, por lo que aún sería posible extraer más energía química de ella. El destino del piruvato, sin embargo, depende de la naturaleza de la célula y de las condiciones en las que ésta se desarrolle: las células aerobias que disponen de oxígeno van a seguir aprovechando la energía contenida en esa molécula, gracias a la respiración celular, pero las células que no disponen de oxígeno, o que son incapaces de utilizarlo, no pueden obtener más energía de esta molécula.
Fermentaciones
Las fermentaciones son, igual que la glucolisis, rutas metabólicas características de la falta (o insuficiencia) de oxígeno ambiental. En esas condiciones, el NADH+H+ no puede ser utilizado por la célula para transformarlo en ATP, sino que su función celular consiste simplemente en recibir los protones y los electrones desprendidos en otras reacciones celulares. Una vez conseguido esto, su papel se agota, y lo que la célula necesita es regenerar el NAD+, cuya síntesis es costosa, para seguir realizando su metabolismo.
Algo similar ocurre con el piruvato. Mientras que las células aerobias pueden seguir degradándolo y obteniendo la energía que aún contiene, si no hay oxígeno disponible es una molécula que resulta "inútil" para la célula, por lo que su destino final es su eliminación.
Las fermentaciones van a dar solución a ambos problemas cuando la célula se encuentra en un ambiente anaerobio: por una parte, van a ceder los electrones y los protones del NADH+H+ al piruvato (o a una sustancia relacionada con él), regenerando así la coenzima que necesitan para seguir funcionando, y por otra van a sintetizar un derivado del piruvato, que incluya esos protones y esos electrones, que va a ser eliminado como sustancia de desecho.
Evolutivamente, por tanto, las fermentaciones constituían la fase final de la degradación anaerobia de la glucosa, en la que la célula se liberaba de sus residuos y regeneraba sus coenzimas. En la actualidad, la mayor parte de los organismos que llevan a cabo fermentaciones lo hacen como adaptación a condiciones de falta de oxígeno, ya sea porque escasea en el ambiente en el que se encuentran, ya sea porque el metabolismo de la propia célula es tan activo que no recibe la cantidad suficiente de este gas para mantenerlo (por ejemplo, las células musculares en condiciones de un esfuerzo muy intenso no llegan a recibir un aporte de oxígeno suficiente para quemar completamente la glucosa, y se ven obligadas a degradar el piruvato mediante la fermentación láctica).
Existen diferentes tipos de fermentación, que dan lugar a la transformación del piruvato en distintos compuestos:
- La fermentación láctica transforma el piruvato en lactato. Es la que se produce en las células musculares cuando escasea el oxígeno y la que llevan a cabo algunas bacterias.
- La fermentación alcohólica transforma el piruvato en etanol, después de eliminar una molécula de dióxido de carbono (descarboxilación). Es característica de muchas levaduras.
- La fermentación acética transforma el piruvato en acetato, también tras una descarboxilación. Es propia de bacterias del género Acetobacter.
Uso industrial de las fermentaciones
El hombre ha aprovechado las fermentaciones desde la antigüedad como proceso para transformar ciertos alimentos y aprovechar algunas características de los productos transformados. Por ejemplo, todas las bebidas alcohólicas son productos de la fermentación alcohólica de diferentes vegetales, llevadas a cabo por la levadura Saccharomyces cerevisiae. La levadura aprovecha parte de los azúcares presentes en el vegetal de partida (cebada en el caso de la cerveza, uva en el del vino...) produciendo alcohol y, en algunos casos, dióxido de carbono (si hay suficiente oxígeno). Otras fermentaciones aprovechadas industrialmente incluyen, por ejemplo, la producción de yogur (fermentación láctica) o la de vinagre (fermentación acética), entre muchas otras.