ENZIMAS
TEXTO TOMADO DE: HTTP://ACADEMIA.CCH.UNAM.MX/WIKI/BIOLOGIA3Y4/INDEX.PHP/METABOLISMO
Chicos :Aquí la información para las clases de miércoles, jueves y viernes.
Es el texto más el juego de las enzimas.
_______________________--------______________
_______________________--------______________
Las enzimas son un tipo de proteínas sintetizadas por los seres vivos que catalizan (aceleran o retardan) una reacción química termodinámicamente posible.
Una característica de los seres vivos, es su capacidad para llevar a cabo reacciones químicas a gran velocidad a temperatura ambiente. Si estas mismas reacciones se realizaran fuera de la célula (in vitro) lo harían muy lentamente.
La mayoría de las reacciones químicas solamente se realizan a temperaturas elevadas y, como todos los sistemas vivos requieren de un número muy elevado de reacciones químicas para mantenerse como tales y al mismo tiempo no soportan la elevada temperatura (principalmente porque se desnaturalizan sus proteínas), la única manera de realizarlas es mediante el uso de enzimas.
Las enzimas pueden trabajar en concentraciones muy bajas, y eso representa una ventaja para los sistemas vivos, ya que normalmente no requieren de una alta concentración de ellas para catalizar sus vitales reacciones químicas. Sin embargo, su naturaleza proteica les confiere especificidad, lo que quiere decir que solamente catalizan un tipo de reacción, por lo que se necesita de miles de enzimas diferentes para poder realizar todas sus reacciones. Por su misma naturaleza proteica se ven afectadas en su actividad catalítica por la acción del pH, calor, y disolventes orgánicos que pueden desnaturalizarlas.
Clasificación. Las enzimas se pueden clasificar de diferentes maneras, pero la clasificación internacional se puede ver en el cuadro 1.1
Oxidorreductasas. Intervienen en los procesos de oxidación fisiológica. Estas enzimas emplean como aceptores de hidrógeno a los nucleótidos de piridina NAD (nicotinamida adenin dinucleótido) NADP (nicotinamida adenin dinucléotido fosfato) al FAD (flavin adenin dinucléotido) o al O2.
Transferasas. Se encargan de catalizar la transferencia de grupos químicos de un sustrato a otro. Un ejemplo de este tipo de enzimas es la transaminasa, que transfiere grupos amino de una molécula a otra.
Hidrolasas. Catalizan reacciones hidrolíticas y entre ellas se encuentran las enzimas digestivas como la amilasa, sacarasa, lipasa y proteasa.
Liasas. Son enzimas que rompen ligaduras entre carbonos, entre carbono y oxígeno y entre carbono y nitrógeno además de otros enlaces por medios diferentes a la hidrólisis y a la oxidación. En las reacciones de las liasas intervienen numerosas coenzimas.
Isomerasas. Catalizan reacciones en las que una molécula sustrato se convierte en un isómero.
Nomenclatura. Para darle nombre a una enzima, se utiliza el nombre del sustrato sobre el que actúa, añadiendo el sufijo asa. Por ejemplo; la amilasa que actúa sobre el almidón, las lipasas que actúan sobre los lípidos y las proteasas que actúan sobre las proteínas. En algunos casos se les han dado nombre que no siguen esta nomenclatura, pero que son generalmente empleados como en el caso de la pepsina y tripsina (enzimas digestivas), por lo cual se ha establecido una nomenclatura y clasificación sistemática por parte de la International Enzyme Comission, que se emplea más en las publicaciones científicas, o cuando se requiere de una identificación exacta. Para el uso común es más práctica la nomenclatura primeramente descrita.
Características de las enzimas. Desde el punto de vista estructural hay dos tipos de enzimas; Las que son proteínas puras y las que están compuestas por una apoenzima (la enzima propiamente dicha) de naturaleza proteica, que para su activación requiere de un cofactor. El cofactor puede ser de cualquiera de los tres tipos siguientes: a)Grupo prostético b)Coenzima c) Activadores metálicos
El grupo prostético es un cofactor que se encuentra firmemente unido a la parte proteica. La coenzima es una molécula orgánica pequeña, termoestable, y que se puede separar fácilmente de la parte proteica. El último cofactor son cationes metálicos mono o divalentes , tales como K+, Mn2+,Mg2+,Ca2+,Zn2+ que pueden estar débil o fuertemente adheridos a la enzima. Cuando se separa a la apoenzima de su cofactor, ésta permanece inactiva. La mayoría de las enzimas son de este último tipo y recibe el nombre de holoenzima cuando la apoenzima esta unida a su cofactor (figura 1.1).
Todas las enzimas comparten cuatro características:
1) Únicamente catalizan reacciones termodinámicamente posibles, pero lo hacen a gran velocidad.
2) Las enzimas no se ven alteradas permanentemente a consecuencia de las reacciones que catalizan, por lo cual la misma enzima puede catalizar innumerables veces la reacción.
3) La misma enzima puede trabajar en la reacción inversa.
4) Las enzimas son altamente específicas y actúan únicamente sobre un sustrato.
El sustrato son moléculas que la enzima puede reconocer químicamente, unirse a ellas y actuar para catalizar una reacción específica.
Interacciones Enzima-sustrato.
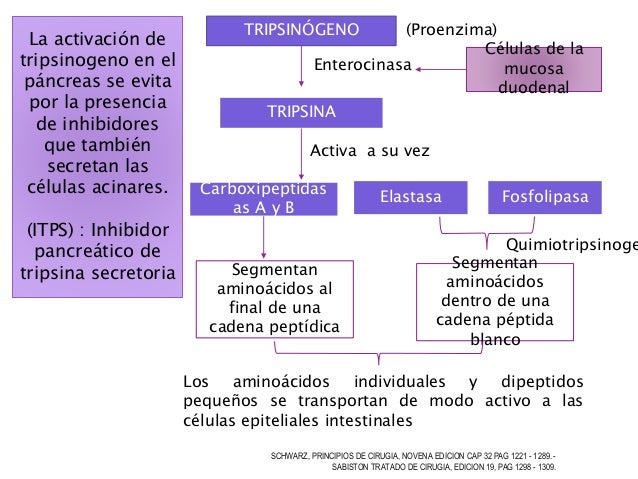
Sitio activo. Ya que las enzimas son específicas para un sustrato, se debe tener un mecanismo de reconocimiento del sustrato a catalizar. El mecanismo consiste en una porción de la molécula de la enzima llamado “sitio activo” (figura 1.2). Este sitio suele consistir en un grupo de aminoácidos específicos. Por ejemplo; El tripsinógeno (enzima del jugo pancreático) se convierte en la enzima activa “tripsina” por la acción de la enzima enteroquinasa o incluso por la propia tripsina.
La estructura primaria del tripsinógeno es una cadena polipeptídica que al convertirse en tripsina se separa un hexapéptido a partir del grupo amino terminal y se produce un cambio en la estructura primaria de la proteína para exponer los sitios catalíticamente activos que contienen residuos de serina y de histidina.
La forma de actuar de una enzima es cuando el sustrato se fija al sitio activo de la enzima, o sea que tiene una forma complementaria, éste se modifica cuando se une al sustrato. A este proceso dinámico se le conoce como acomodo inducido. Una vez que el sustrato está en el sitio activo, en su conjunto reciben el nombre de complejo enzima-sustrato y se lleva a cabo la función catalítica (figura 1.3).
Sin embargo, será necesaria una mínima cantidad de energía, la cual recibe el nombre de energía de activación. Lo cual quiere decir que las reacciones no se llevan a cabo libremente, sino que los componentes están en una situación químicamente estable y únicamente reaccionan cuando se les aplica una cierta cantidad de energía. Cuando una reacción química se realiza fuera de la célula se libera bruscamente energía en forma de calor, pero en las células vivas la liberación de calor se realiza poco a poco y en cantidades pequeñas que permiten el aprovechamiento de la energía al máximo.
Factores que afectan la actividad enzimática.
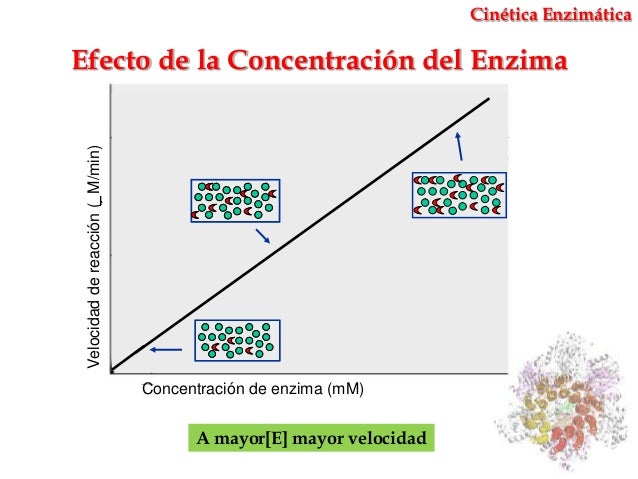
No todas las enzimas funcionan de la misma manera y en cualquier situación ambiental, ya que cada tipo de enzima tiene un rango de temperatura y pH en el que su desempeño es mejor, esto significa que la reacción es más rápida y por lo tanto, la formación de producto también lo es. Normalmente la velocidad de la reacción catalizada es directamente proporcional a la concentración de la enzima
En la figura 1.4 se muestra la relación de producto (compuesto transformado) y la concentración de enzima. A mayor cantidad de enzima presente en un mismo tiempo, se obtiene una mayor cantidad de producto cuando se tiene una cantidad ilimitada de sustrato. Pero si mantenemos la concentración de enzima fija y aumentamos la concentración de sustrato, se puede obtener una curva como la siguiente (Figura 1.5).
Un aumento en la cantidad de sustrato cuando la concentración de enzima es fija, produce al principio un aumento en la velocidad de la reacción, pero a medida que la concentración de sustrato va aumentando la velocidad de la reacción va disminuyendo hasta llegar a un punto en el cual se estabiliza (velocidad máxima de reacción) y, de este punto en adelante, aunque se continúe aumentando la cantidad de sustrato, la enzima ya saturada, no puede aumentar la cantidad de producto.
En la figura 1.5 la cinética de primer orden se refiere a una aceleración en la que la conversión del sustrato A al producto B es directamente proporcional a la concentración de sustrato. La cinética de orden cero, se refiere a que la enzima esta trabajando a su máxima capacidad y que por lo tanto ya es imposible acelerar la reacción. La cinética de orden cero no significa que la enzima no está trabajando, sino que ya no puede trabajar a una velocidad mayor. La mezcla de cinética de primer orden y de orden cero se refiere a la etapa en la cual empieza a declinar la velocidad porque esta empezando a saturarse la enzima, y está disminuyendo su aceleración poco a poco hasta llegar a la saturación. Esto quiere decir, que es capaz de transformar una cierta cantidad de sustrato A al producto B por unidad de tiempo a una determinada concentración y no más.
Efecto de la temperatura. Como cualquier tipo de proteína, las enzimas se ven afectadas por la temperatura, especialmente cuando esta es alta. Las reacciones químicas normalmente se aceleran al aumentar la temperatura, ya que la alta temperatura incrementa la velocidad molecular (aumenta la velocidad de colisión entre moléculas) y las reacciones ocurren más frecuentemente. Cualquier microorganismo crecerá más rápidamente a mayor temperatura que a temperaturas más bajas, razón por la cual se utiliza el refrigerador para conservar los alimentos, no porque no puedan crecer los microorganismos en el refrigerador, sino porque crecen a mucho menor velocidad. Así también se explica porque el yogurt se produce más rápidamente a temperaturas entre 25 y 300 C y no a menores temperaturas. Sin embargo el aumento constante de la temperatura no garantiza una mayor velocidad de reacción, ya que se llegará a una temperatura en el que las enzimas en lugar de aumentar su velocidad de reacción, la disminuyen, e incluso en algún punto ésta se detiene (figura 1.6). Esto se debe a que las altas temperaturas dañan a las proteínas de las que están formadas las enzimas. El calor excesivo rompe los puentes de hidrógeno y otras fuerzas intermoleculares que dan estabilidad a la estructura tridimensional de las proteínas. Así, las enzimas cambian de forma, pierden solubilidad y se coagulan. Esto último le pasa a las proteínas del huevo cuando se cocina, ya que las proteínas de huevo se desnaturalizan perdiendo su capacidad funcional. Esto mismo puede pasar cuando tenemos fiebre alta. Un humano puede morir cuando su temperatura interna alcanza los 44 grados Centígrados.
Una vez que una enzima ha sido dañada por altas temperaturas ya no se puede volver nuevamente funcional. Esta es la razón por la que es más seguro comer alimentos cocinados que crudos, ya que al cocinarse, las altas temperaturas inactivan las enzimas de los microorganismos presentes y éstos mueren.
A diferencia de las altas temperaturas, las temperaturas bajas no producen daño permanente a las enzimas, usualmente al bajar la temperatura la actividad enzimática disminuye y hasta puede detenerse, pero al aumentar la temperatura la enzima puede volver a activarse.
Efecto del pH. La acidez o alcalinidad del medio en el que se encuentre una enzima puede afectar sus propiedades catalíticas (sabemos que el pH neutro es de 7, y que cualquier valor por debajo de 7 corresponde a un medio ácido. Así, los valores ácidos van del 0 al 7; entre más ácida es una solución su pH será más bajo. Por arriba de 7 y hasta un valor de 14 tenemos los pH alcalinos; entre más alto el valor del pH por arriba de 7, más alcalina es la solución) (figura 1.7).
Debido a que las enzimas son proteínas, éstas se pueden ver afectadas en sus grupos amino y carboxilo que son de carácter iónico, y en consecuencia, modificar sus propiedades catalíticas. Un alto nivel de acidez o alcalinidad pueden producir desnaturalización de las proteínas.
En las células existen sustancias amortiguadoras del pH que evitan que el citoplasma se acidifique o alcalinice y lo mantienen en un pH adecuado o muy cercano a él. Al igual que las bajas temperaturas el pH ácido puede ser usado para conservar alimentos (por ejemplo; en vinagre, que es ácido acético), ya que las enzimas de los microbios que descomponen los alimentos no pueden tolerar las condiciones ácidas.
Juega con las enzimas.
1o.- Utiliza el navegador Internet Explorer, de tu computadora.
2o.- Accede al siguiente enlace: simulador de la actividad enzimática juega con la cantidad de enzimas, los sustratos, el pH, los inhibidores e inclusive el tamaño del recipiente.
[Si utilizas otro navegador sólo descarga un archivo que no es posible utilizar.]
Observa cómo es que se forman los productos (esferas rojas) de acuerdo a tus cambios. Escribe 4 observaciones en tu cuaderno y sus resultados de acuerdo a los cambios que realizaste .
Para poder jugar necesitas apretar el botón cambiar datos y luego el de Play
http://www.bionova.org.es/animbio/anim/cinetica.swf
Para poder jugar necesitas apretar el botón cambiar datos y luego el de Play
http://www.bionova.org.es/animbio/anim/cinetica.swf










No hay comentarios:
Publicar un comentario